O abordare alternativă a fenomenelor termodinamice o reprezintă mecanica statistică. Pornind de la structura microscopică (molecule şi atomi), luând în considerare interacţiunile (forţele) dintre aceste componente şi folosind metode statistice (aplicabile sistemelor alcătuite dintr-un număr foarte mare de componente), mecanica statistică poate, cu preţul unor calcule laborioase, să deducă (şi prin aceasta să confirme) rezultatele obţinute de termodinamică pe cale fenomenologică.
Pentru orice disciplină a fizicii, obiectul de studiu este un sistem. În contextul termodinamicii acesta va fi un sistem termodinamic: o porţiune finită, precis delimitată, din realitatea materială, care poate include atât substanţă cât şi radiaţie. Delimitarea conceptuală a unui sistem de lumea înconjurătoare nu exclude, ci în general presupune, interacţiunea acestor două elemente; în cazul termodinamicii, această interacţiune se manifestă sub forma de fenomene termice şi mecanice.
Calitativ, se numeşte stare a unui sistem (la un moment dat) totalitatea proprietăţilor lui (la acel moment). Pentru precizarea cantitativă a acestei noţiuni se recurge la valorile pe care le au diferite mărimi fizice în starea respectivă. Între mărimile care exprimă proprietăţi ale unui sistem există relaţii cantitative bine determinate; există însă un număr limitat de mărimi fizice independente care caracterizează complet starea sa, alte proprietăţi ale sistemului putând fi derivate din acestea. Alegerea mărimilor care să servească drept variabile independente este un pas preliminar necesar în studiul oricărui sistem.
O stare în care proprietăţile sistemului (termodinamic) nu variază în timp se numeşte stare de echilibru (termodinamic).
Principiul zero al termodinamicii
Pentru detalii, vezi: Principiul zero al termodinamicii.
Pentru ca un sistem să se afle în echilibru termodinamic este necesar (dar în general nu şi suficient) ca lumea înconjurătoare cu care se află în contact să ofere condiţii neschimbate în timp. Următoarea constatare, de natură experimentală, este numită uneori principiul zero al termodinamicii:[1][2]- Un sistem termodinamic situat în condiţii externe invariabile în timp va atinge, după un timp suficient de lung, o stare de echilibru termodinamic.
Lucru mecanic
O stare de echilibru mecanic a unui sistem cu grade de libertate este caracterizată complet de valorile pe care le au variabilele de poziţie
grade de libertate este caracterizată complet de valorile pe care le au variabilele de poziţie la starea finală
la starea finală  trecând prin stări intermediare înşiruite de-a lungul curbei continue
trecând prin stări intermediare înşiruite de-a lungul curbei continue  în spaţiul variabilelor de poziţie
în spaţiul variabilelor de poziţie  este
este în sensul de la
în sensul de la 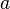 spre
spre 
Principiul întâi al termodinamicii

Rudolf Julius Emanuel Clausius (1822–1888) a dat formularea clasică a principiului întâi al termodinamicii şi a reformulat principiul al doilea pe baza noţiunii de entropie.
Pentru detalii, vezi: Principiul întâi al termodinamicii.
Energie internă
O serie de experimente esenţiale pentru fundamentarea teoretică a termodinamicii au fost efectuate asupra unor sisteme separate de lumea înconjurătoare printr-un înveliş adiabatic. Un asemenea înveliş are însuşirea că, odată aplicat unui sistem aflat în echilibru termodinamic, starea acestui sistem poate fi schimbată numai prin efectuarea de lucru mecanic de către forţe acţionând din exterior asupra sistemului. O transformare a unui sistem închis în înveliş adiabatic se numeşte transformare adiabatică. Sinteza rezultatelor experimentelor amintite constituie formularea clasică a principiului întâi al termodinamicii:[4]- În orice transformare adiabatică a unui sistem, lucrul mecanic efectuat de forţele exterioare depinde numai de starea iniţială şi de starea finală a sistemului.
 produs într-o transformare adiabatică de la o stare iniţială
produs într-o transformare adiabatică de la o stare iniţială 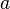 la o stare finală
la o stare finală 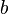 este independent de stările intermediare (curba
este independent de stările intermediare (curba  ) şi există o funcţie
) şi există o funcţie  astfel încât
astfel încât  Funcţia
FuncţiaCantitate de căldură
Într-o transformare diatermică (neadiabatică) lucrul mecanic depinde, în general, de stările intermediare, iar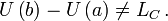 Mărimea definită prin relaţia
Mărimea definită prin relaţia- Pentru orice sistem termodinamic există o funcţie de stare numită energie internă. În orice transformare prin care trece sistemul, variaţia energiei interne este egală cu suma dintre lucrul mecanic efectuat asupra sistemului şi cantitatea de căldură transferată către sistem.
Măsurarea cantităţii de căldură face obiectul calorimetriei. Metodele calorimetrice deduc cantitatea de căldură schimbată cu exteriorul de un sistem oarecare comparând starea sa iniţială cu cea finală. Deoarece însă cantitatea de căldură schimbată depinde în general de stările intermediare, măsurătoarea poate fi univocă numai dacă procesul de măsurare e specificat în mai mult detaliu. În măsurători calorimetrice la variabile de poziţie constante, lucrul mecanic efectuat de sistem este nul şi cantitatea de căldură schimbată este egală cu variaţia energiei sale interne
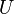 . Aceasta este o funcţie de stare şi variaţia ei este unic determinată de stările iniţială şi finală ale sistemului. În măsurători calorimetrice la variabile de forţă constante, cantitatea de căldură schimbată se dovedeşte a fi egală cu variaţia unei alte funcţii de stare, numită entalpie, care este legată de energie prin relaţia:
. Aceasta este o funcţie de stare şi variaţia ei este unic determinată de stările iniţială şi finală ale sistemului. În măsurători calorimetrice la variabile de forţă constante, cantitatea de căldură schimbată se dovedeşte a fi egală cu variaţia unei alte funcţii de stare, numită entalpie, care este legată de energie prin relaţia:Temperatură (empirică)
Existenţa schimbului de căldură arată că starea unui sistem termodinamic nu este complet caracterizată de variabilele mecanice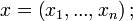 principiul întâi al termodinamicii indică existenţa unei noi variabile de stare, energia internă, măsurabilă prin metode calorimetrice. În practică este preferată o altă variabilă, care exprimă cantitativ senzaţiile familiare de „cald” şi „rece”. Este vorba despre temperatură, care poate fi definită empiric pe baza unui experiment numit contact termic.
principiul întâi al termodinamicii indică existenţa unei noi variabile de stare, energia internă, măsurabilă prin metode calorimetrice. În practică este preferată o altă variabilă, care exprimă cantitativ senzaţiile familiare de „cald” şi „rece”. Este vorba despre temperatură, care poate fi definită empiric pe baza unui experiment numit contact termic.Fie două sisteme, reunite într-un singur sistem, acesta fiind izolat de exterior printr-un înveliş adiabatic. Cele două subsisteme sunt însă separate printr-o interfaţă diatermă (neadiabatică). Variabilele de poziţie ale ambelor subsisteme sunt fixate. În aceste condiţii nu există schimb de lucru mecanic nici cu exteriorul, nici între subsisteme; nu există schimb de căldură cu exteriorul, dar subsistemele pot schimba căldură între ele. Se zice că cele două subsisteme se află în contact termic; iar dacă s-a stabilit, conform principiului zero al termodinamicii, echilibrul termodinamic, se zice că cele două subsisteme se află în echilibru termic.
S-a dovedit în mod empiric corectitudinea următorului enunţ, numit principiul tranzitivităţii echilibrului termic:[1][8]
- Dacă sistemul A este în echilibru termic cu sistemul B şi sistemul B este în echilibru termic cu sistemul C, atunci sistemul A este în echilibru termic cu sistemul C.
 unde
unde  este o funcţie monoton crescătoare de argumentul său, face trecerea de la o scară de temperatură
este o funcţie monoton crescătoare de argumentul său, face trecerea de la o scară de temperatură 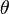 la altă scară de temperatură posibilă
la altă scară de temperatură posibilă 
Două sisteme aflate în echilibru termic au temperaturi egale. Acest fapt stă la baza termometriei, care se ocupă cu măsurarea temperaturilor. Într-o măsurătoare de temperatură, corpul a cărui temperatură urmează a fi măsurată şi instrumentul de măsură sunt puse în contact termic şi se aşteaptă un timp suficient pentru ca ele să ajungă în echilibru termic. Este necesar ca primul să aibă o masă suficient de mare ca temperatura sa să nu fie modificată apreciabil în cursul transferului de căldură care duce la stabilirea echilibrului termic (un sistem care satisface acestei condiţii se numeşte termostat), pe când al doilea trebuie să-şi adapteze temperatura la aceea a primului fără a i-o modifica apreciabil (un astfel de sistem se numeşte termometru).
Ecuaţii de stare
Ţinând cont de existenţa unei variabile de stare termică, pe lângă cele mecanice, şi alegând ca nouă variabilă temperatura, mai intuitivă şi mai uşor accesibilă măsurătorii decât energia internă, relaţiile (2) devinPrincipiul al doilea al termodinamicii

Nicolas Léonard Sadi Carnot (1796–1832) a enunţat teorema lui Carnot, una din formulările primare ale principiului al doilea al termodinamicii.
Pentru detalii, vezi: Principiul al doilea al termodinamicii.
Studiul schimbului de căldură între sisteme s-a dezvoltat din necesitatea practică de a îmbunătăţi funcţionarea maşinilor termice. Din punct de vedere teoretic, o maşină termică este un sistem care, într-o transformare ciclică, primeşte căldură şi cedează lucru mecanic. În cursul transformării, maşina termică schimbă căldură cu un număr de sisteme numite surse de căldură, care se presupune că sunt termostate având temperaturi cunoscute. Transformarea se numeşte monotermă, bitermă sau politermă, după numărul de surse de căldură; sunt imaginabile şi transformări în care se schimbă căldură cu o infinitate de surse de căldură ale căror temperaturi variază continuu.Formularea primară a principiului al doilea al termodinamicii este echivalentă cu constatarea experimentală că nu poate exista o maşină termică cu o singură sursă de căldură:
- Într-o transformare ciclică monotermă, independent de natura sistemului, cantitatea de căldură primită de sistem este negativă sau nulă; ea este nulă dacă şi numai dacă transformarea este reversibilă.[10][11]
- Într-o transformare ciclică bitermă reversibilă, raportul cantităţilor de căldură schimbate de sistem cu cele două termostate nu depinde de natura sistemului; el depinde numai de temperaturile celor două termostate.
 şi
şi  temperaturile termostatelor, iar cu
temperaturile termostatelor, iar cu 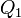 şi
şi 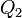 cantităţile de căldură respective, avem aşadar
cantităţile de căldură respective, avem aşadar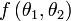 nu depinde de natura sistemului. Maşina termică bitermă reversibilă descrisă poartă numele istoric de maşină Carnot, ea funcţionând după un ciclu Carnot, iar enunţul precedent este echivalent cu teorema lui Carnot: randamentul unui ciclu Carnot depinde numai de temperaturile celor două surse de căldură.[13]
nu depinde de natura sistemului. Maşina termică bitermă reversibilă descrisă poartă numele istoric de maşină Carnot, ea funcţionând după un ciclu Carnot, iar enunţul precedent este echivalent cu teorema lui Carnot: randamentul unui ciclu Carnot depinde numai de temperaturile celor două surse de căldură.[13]Temperatură (termodinamică)
Analiza detaliată a schimbului de căldură în transformări ciclice biterme reversibile şi ireversibile[14] arată că funcţia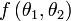 definită prin relaţia (14) poate fi factorizată în forma
definită prin relaţia (14) poate fi factorizată în forma este o funcţie continuă, monoton crescătoare, cu valori strict pozitive şi mărginită (nu se poate anula şi nu poate deveni infinită) de temperatura
este o funcţie continuă, monoton crescătoare, cu valori strict pozitive şi mărginită (nu se poate anula şi nu poate deveni infinită) de temperatura  definită până la o constantă multiplicativă pozitivă. Ea defineşte aşadar o scară de temperatură. Odată fixat prin convenţie factorul multiplicativ, temperatura definită prin relaţia
definită până la o constantă multiplicativă pozitivă. Ea defineşte aşadar o scară de temperatură. Odată fixat prin convenţie factorul multiplicativ, temperatura definită prin relaţia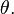
Introducând temperaturile absolute
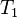 şi
şi 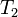 ale termostatelor cu care se schimbă cantităţile de căldură
ale termostatelor cu care se schimbă cantităţile de căldură 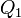 şi
şi 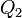 într-o transformare ciclică bitermă reversibilă, relaţia (14) poate fi rescrisă ca
într-o transformare ciclică bitermă reversibilă, relaţia (14) poate fi rescrisă ca surse de căldură sub forma
surse de căldură sub formaConform formulării primare a principiului al doilea al termodinamicii, într-o transformare ciclică monotermă ireversibilă cantitatea de căldură primită de sistem este strict negativă. Pe de altă parte, o transformare complexă care conţine atât porţiuni reversibile cât şi porţiuni ireversibile este, în ansamblu, ireversibilă. Pornind de la aceste constatări se obţine pe cale deductivă[15] inegalitatea lui Clausius pentru cazul unei transformări ciclice politerme ireversibile:
Entropie
Considerăm acum cazul unei transformări ciclice reversibile care constă dintr-o înşiruire de transformări elementare, în fiecare dintre acestea sistemul schimbând cantitatea de căldură cu un termostat de temperatură
cu un termostat de temperatură 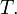 Reducând „pasul” acestor transformări elementare şi crescând numărul lor, se obţine la limită o transformare ciclică reversibilă în care se schimbă căldură cu termostate ale căror temperaturi variază continuu. În această limită egalitatea lui Clausius (18) devine
Reducând „pasul” acestor transformări elementare şi crescând numărul lor, se obţine la limită o transformare ciclică reversibilă în care se schimbă căldură cu termostate ale căror temperaturi variază continuu. În această limită egalitatea lui Clausius (18) devine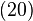
 (într-o transformare reversibilă)
(într-o transformare reversibilă)
 care conţine numai stări de echilibru.
care conţine numai stări de echilibru.Rezultă atunci din teorema de integrabilitate[5] că există o funcţie de stare, definită până la o constantă aditivă, numită entropie şi notată tradiţional cu
 a cărei diferenţială totală este
a cărei diferenţială totală este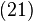
 (într-o transformare reversibilă)
(într-o transformare reversibilă)
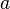 la o stare finală
la o stare finală 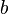 este independentă de drumul urmat
este independentă de drumul urmat  şi reprezintă variaţia funcţiei între starea iniţială şi starea finală:
şi reprezintă variaţia funcţiei între starea iniţială şi starea finală:
 (într-o transformare reversibilă)
(într-o transformare reversibilă)

 (într-o transformare ireversibilă)
(într-o transformare ireversibilă)
- Pentru orice sistem termodinamic există o funcţie de stare numită entropie. În orice transformare prin care trece sistemul, variaţia entropiei este mărginită inferior de cantitatea
 unde drumul de integrare este curba
unde drumul de integrare este curba  care uneşte starea iniţială cu starea finală, trecând prin stări intermediare în care se schimbă cantităţi de căldură
care uneşte starea iniţială cu starea finală, trecând prin stări intermediare în care se schimbă cantităţi de căldură  cu o înşiruire continuă de termostate la temperaturi
cu o înşiruire continuă de termostate la temperaturi 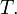 Marginea inferioară este atinsă dacă şi numai dacă transformarea este reversibilă.
Marginea inferioară este atinsă dacă şi numai dacă transformarea este reversibilă.
Stări de echilibru

Josiah Willard Gibbs (1796–1832) a introdus noţiunea de potenţial chimic; lucrările sale au pus bazele teoretice ale termodinamicii chimice şi chimiei fizice.
Potenţiale termodinamice
Pentru detalii, vezi: Potenţial termodinamic.
În ecuaţiile caracteristice (12) şi (13), transcrise acum în scara termodinamică de temperatură, sau/şi
sau/şi  se rearanjează expresia diferenţială[16]
se rearanjează expresia diferenţială[16]- Energie internă U (S, x)
- Entropie S (U, x)
- Entalpie H (S, X)
- Energie liberă F (T, x)
- Entalpie liberă G (T, X)
Schimb de căldură
Parametrizările de mai jos ale cantităţii de căldură schimbată într-o transformare elementară reversibilă definesc proprietăţi ale sistemului numite (impropriu) constante de material. Ele se determină prin metode calorimetrice şi sunt importante în aplicaţiile practice.- Capacitatea termică la variabile
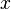 constante
constante  şi căldura latentă la variaţia variabilei
şi căldura latentă la variaţia variabilei 
- Capacitatea termică la variabile
 constante
constante  şi căldura latentă la variaţia variabilei
şi căldura latentă la variaţia variabilei 
Schimb de substanţă
Există transformări în care, pe lângă schimb de căldură şi lucru mecanic, are loc un schimb de substanţă. De exemplu, o cantitate de fluid schimbă substanţă cu exteriorul în cursul proceselor de evaporare şi condensare. Noţiunea de sistem termodinamic poate fi lărgită, pentru a include astfel de fenomene în care masele componentelor sistemului se modifică.Fie un sistem cu
 componente, de mase variabile
componente, de mase variabile  care se adaugă variabilelor de stare. Alegând ca potenţial termodinamic entalpia liberă, aceasta va fi o funcţie
care se adaugă variabilelor de stare. Alegând ca potenţial termodinamic entalpia liberă, aceasta va fi o funcţie  Relaţiiile (31) trebuie completate pentru a ţine cont de noile variabile:
Relaţiiile (31) trebuie completate pentru a ţine cont de noile variabile: definite în (35) se numesc potenţiale chimice ale componentelor respective. În acest formalism masele componentelor apar ca variabile de poziţie, potenţialele chimice asociate apar ca variabile de forţă, iar contribuţia schimbului de substanţă
definite în (35) se numesc potenţiale chimice ale componentelor respective. În acest formalism masele componentelor apar ca variabile de poziţie, potenţialele chimice asociate apar ca variabile de forţă, iar contribuţia schimbului de substanţă  are aspectul unui lucru mecanic. Aplicaţiile în termodinamica chimică şi chimia fizică sunt numeroase, la procese ca tranziţii de fază sau reacţii chimice.
are aspectul unui lucru mecanic. Aplicaţiile în termodinamica chimică şi chimia fizică sunt numeroase, la procese ca tranziţii de fază sau reacţii chimice.Transformări ireversibile
Prin definiţie, un sistem aflat într-o stare de echilibru va rămâne în această stare un timp indefinit, dacă nu se schimbă condiţiile exterioare. Dacă aceste condiţii se schimbă, echilibrul va fi perturbat şi sistemul va începe o transformare care, după un timp suficient de lung, se va termina într-o nouă stare de echilibru, compatibil cu noile condiţii. Dacă transformarea este ireversibilă, termodinamica nu-i poate descrie desfăşurarea, fiindcă stările intermediare nu sunt stări de echilibru. Dată o stare iniţială termodinamica poate doar indica unele caracteristici ale stării finale
termodinamica poate doar indica unele caracteristici ale stării finale  compatibilă cu noile condiţii de echilibru.
compatibilă cu noile condiţii de echilibru.- Pentru o transformare ireversibilă adiabatică (în care nu se schimbă căldură cu exteriorul), din relaţia (23) rezultă
 Starea finală de echilibru este realizată atunci când entropia are valoarea maximă compatibilă cu noile condiţii de echilibru.
Starea finală de echilibru este realizată atunci când entropia are valoarea maximă compatibilă cu noile condiţii de echilibru.
- Pentru o transformare ireversibilă izotermă (sistemul este tot timpul în contact cu un termostat) în care variabilele de poziţie rămân constante, inegalitatea precedentă poate fi transcrisă în funcţie de energia liberă (30) sub forma
 Starea finală de echilibru se realizează atunci când energia liberă are valoarea minimă.
Starea finală de echilibru se realizează atunci când energia liberă are valoarea minimă.
- Pentru o transformare ireversibilă izotermă în care variabilele de forţă rămân constante în tot timpul procesului, inegalitatea, transcrisă în funcţie de entalpia liberă (31), devine
 Starea finală de echilibru se realizează atunci când entalpia liberă are valoarea minimă.
Starea finală de echilibru se realizează atunci când entalpia liberă are valoarea minimă.
Principiul al treilea al termodinamicii

Walther Nernst (1864–1941) a enunţat teorema lui Nernst care, în reformularea lui Max Planck, a devenit principiul al treilea al termodinamicii.
Pentru detalii, vezi: Principiul al treilea al termodinamicii.
Din principiul al doilea al termodinamicii rezultă că, în transformări în care variabilele de poziţie rămân constante, ca şi în transformări în care variabilele de forţă rămân constante, entropia este o funcţie monoton crescătoare de temperatura absolută.[18] Conform unei teoreme elementare din analiza matematică, atunci când, în cursul unei asemenea transformări, temperatura se apropie de zero absolut (valoare pe care nu o poate atinge), entropia va tinde către o valoare finită sau către  Dacă tinde către o valoare finită, aceasta este independentă de celelalte variabile de stare şi, întrucât entropia este definită până la o constantă aditivă, ea poate fi aleasă zero prin convenţie. Afirmaţia că acesta este cazul, pentru orice sistem, constituie principiul al treilea al termodinamicii:
Dacă tinde către o valoare finită, aceasta este independentă de celelalte variabile de stare şi, întrucât entropia este definită până la o constantă aditivă, ea poate fi aleasă zero prin convenţie. Afirmaţia că acesta este cazul, pentru orice sistem, constituie principiul al treilea al termodinamicii:- Când temperatura tinde către zero absolut, entropia oricărui sistem tinde către zero.





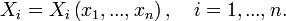





















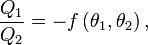
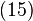
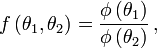





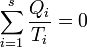

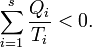
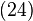


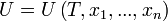

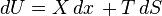



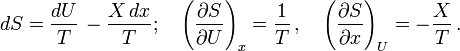















Niciun comentariu:
Trimiteți un comentariu